Hukum Avogadro (
Hipotes Avogadro, atau
Prinsip Avogadro) adalah
hukum gas yang diberi nama sesuai dengan
ilmuwan Italia Amedeo Avogadro, yang pada
1811 mengajukan hipotesis bahwa:
- Gas-gas yang memiliki volum yang sama, pada temperatur dan tekanan yang sama, memiliki jumlah partikel yang sama pula.
Artinya, jumlah
molekul atau
atom dalam suatu
volum gas tidak tergantung kepada ukuran atau
massa dari molekul gas. Sebagai contoh, 1 liter gas
hidrogen dan
nitrogen akan mengandung jumlah molekul yang sama, selama suhu dan tekanannya sama. Aspek ini dapat dinyatakan secara matematis,
 .
.
dimana:
- V adalah volum gas.
- n adalah jumlah mol dalam gas tersebut.
- k adalah tetapan kesebandingan.
Akibat paling penting dari hukum Avogadro adalah bahwa
Konstanta gas ideal memiliki nilai yang sama bagi semua gas. Artinya, konstanta
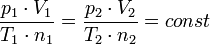
dimana:
- p adalah tekanan gas
- T adalah temperatur
memiliki nilai yang sama untuk semua gas, tidak tergantung pada ukuran atau massa molekul gas. Hipotesis Avogadro dibuktikan melalui teori
kinetika gas.
Satu mol gas ideal memiliki volum 22.4 liter pada
kondisi standar (STP), dan angka ini sering disebut volum molar gas ideal. Gas-gas nyata (non-ideal) memiliki nilai yang berbeda.
 .
.
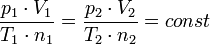
Tidak ada komentar:
Posting Komentar